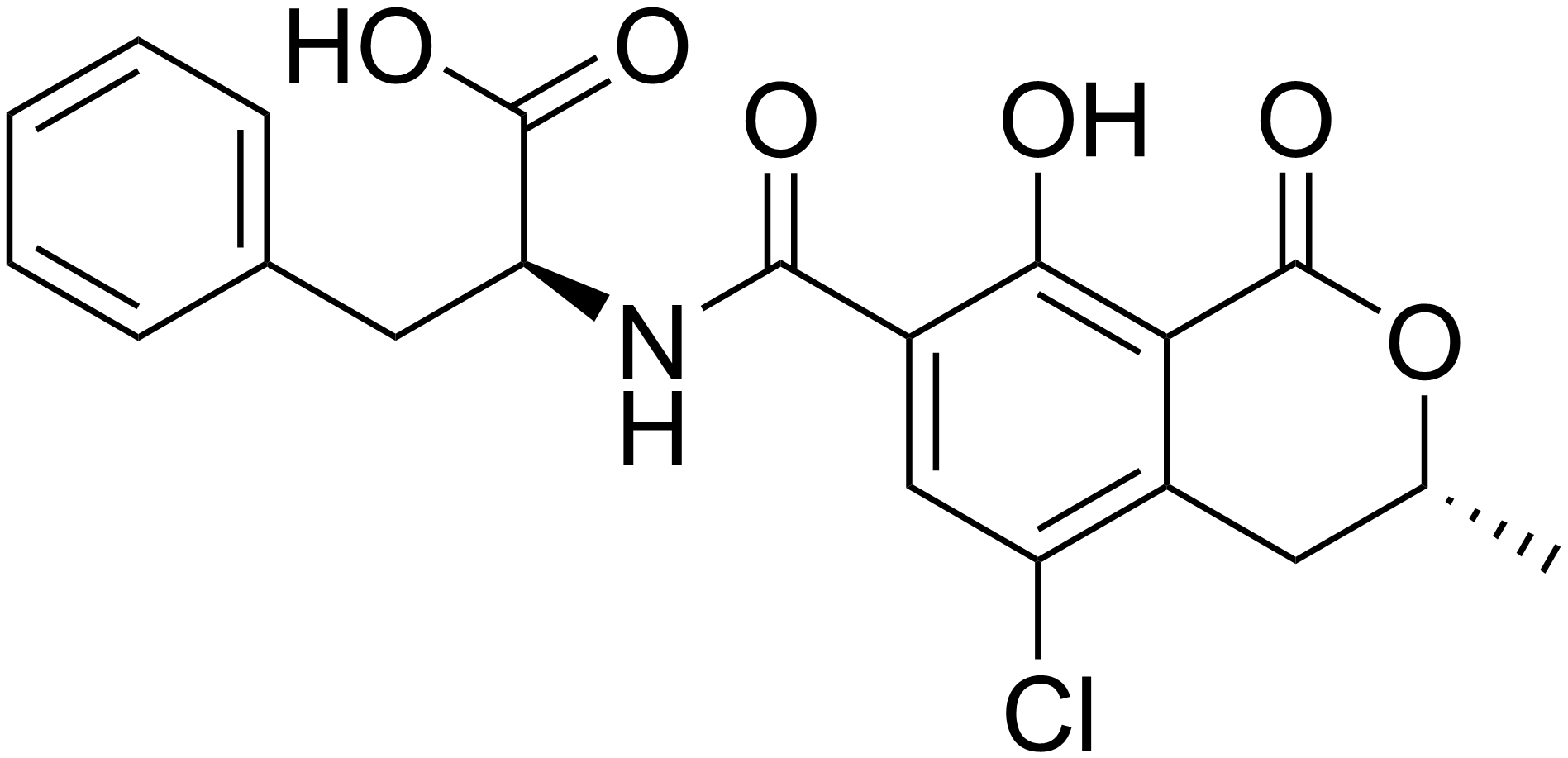
Okratoksin A
Suda az, polar organik çözücüler ile seyreltik sulu sodyum bikarbonat çözeltisinde iyi çözünen, renksiz ve kristal yapıda bir bileşiktir. UV ışınları altında mavi renkte floresan verir. Okratoksin A, 7-karboksi-5-kloro-8- hidroksi-3,4 dihidro-3R-metil-izokumarin içerir ve L-fenilalanine karboksi grup üzerinden bağlanır.
Kimyasal yapısında fenilalanin, Cl ve OH içeren dihidroizokumarin bulunur. Okratoksin A'nın Cl içermeyen türevi Okratoksin B, etilester türevi ise okratoksin C'dir. Okratoksin B ve okratoksin C gıdalarda görülseler de düşük konsantrasyonda bulunduklarından fazlaca önem taşımazlar. Okratoksin A, pankreas ve ince bağırsakta α-kimotripsin ve karboksipeptidaz enzimleri ile okratoksin α’ya hidroliz edilmektedir.
Okratoksin A büyük miktarlarda üretilir ve sık sık gıda ve yemlerde doğal kontaminant olarak rastlanır. Farklı gıdalarda yapılan çalışmalar okratoksin A’nın sıcaklığa karşı dayanıklı olduğunu göstermiştir. Patterson (1977), Josefson ve Möller (1980), Scott (1984), domuz eti ve sakatatların 150-160 ºC sıcaklıkta pişirilmesiyle toksin miktarında % 20 azalma meydana gelirken, yağ dokusunda bulunan toksinde hiç kayıp olmadığını bildirmektedir. Okratoksinle kontamine olmuş un ile yapılan ekmekte pişirme işlemi neticesinde az bir kaybın olduğu gözlenmişken, bisküvi yapımında çok daha fazla toksinin parçalandığı bildirilmiştir (Metin 2006).
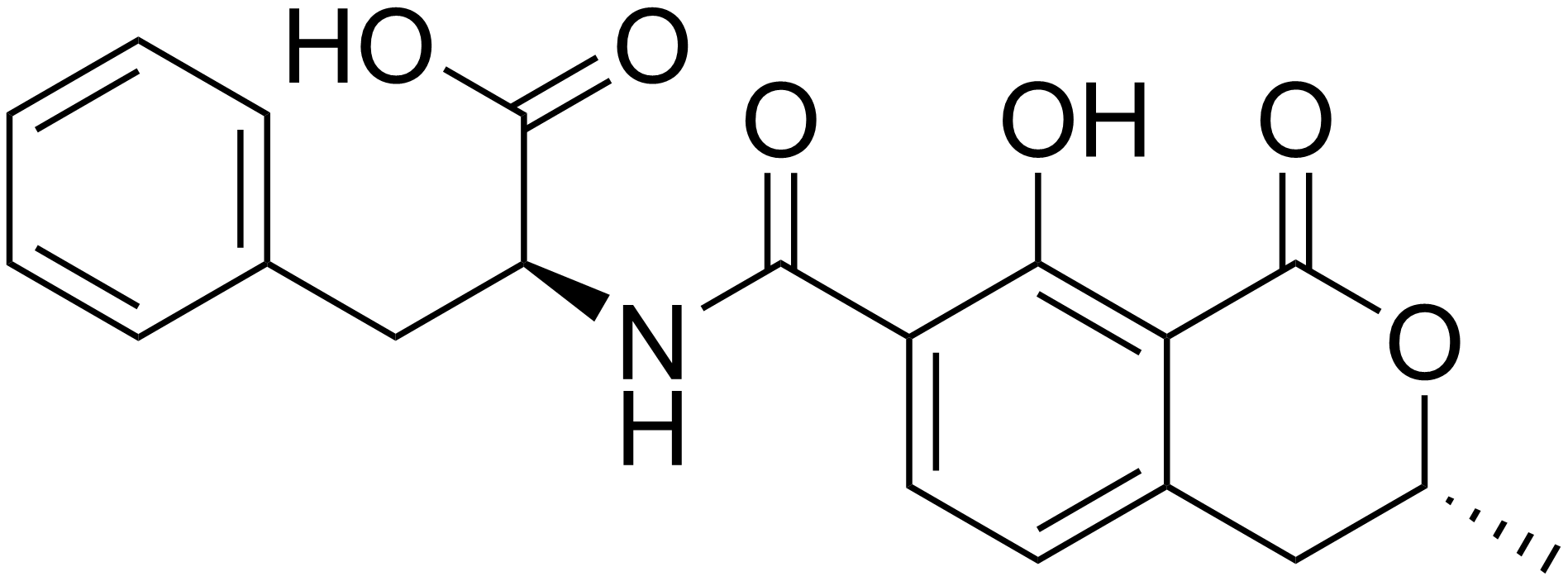
Okratoksin B
Okratoksin B (OTB) A. ochraceus tarafından üretilen sekonder bir metabolittir.
OTA ile birlikte oluşabilir. OTB, moleküler yapının 5. pozisyonundaki klorun eksikliği nedeni ile OTA’dan ayrılmaktadır. Yapısal olarak OTA’ya çok benzer olmasına rağmen daha az toksisiteye sahip olduğu düşünülmektedir. OTB’nin OTA’ya göre daha hızlı metabolize olduğu rapor edilmiştir ( Mally vd 2005).
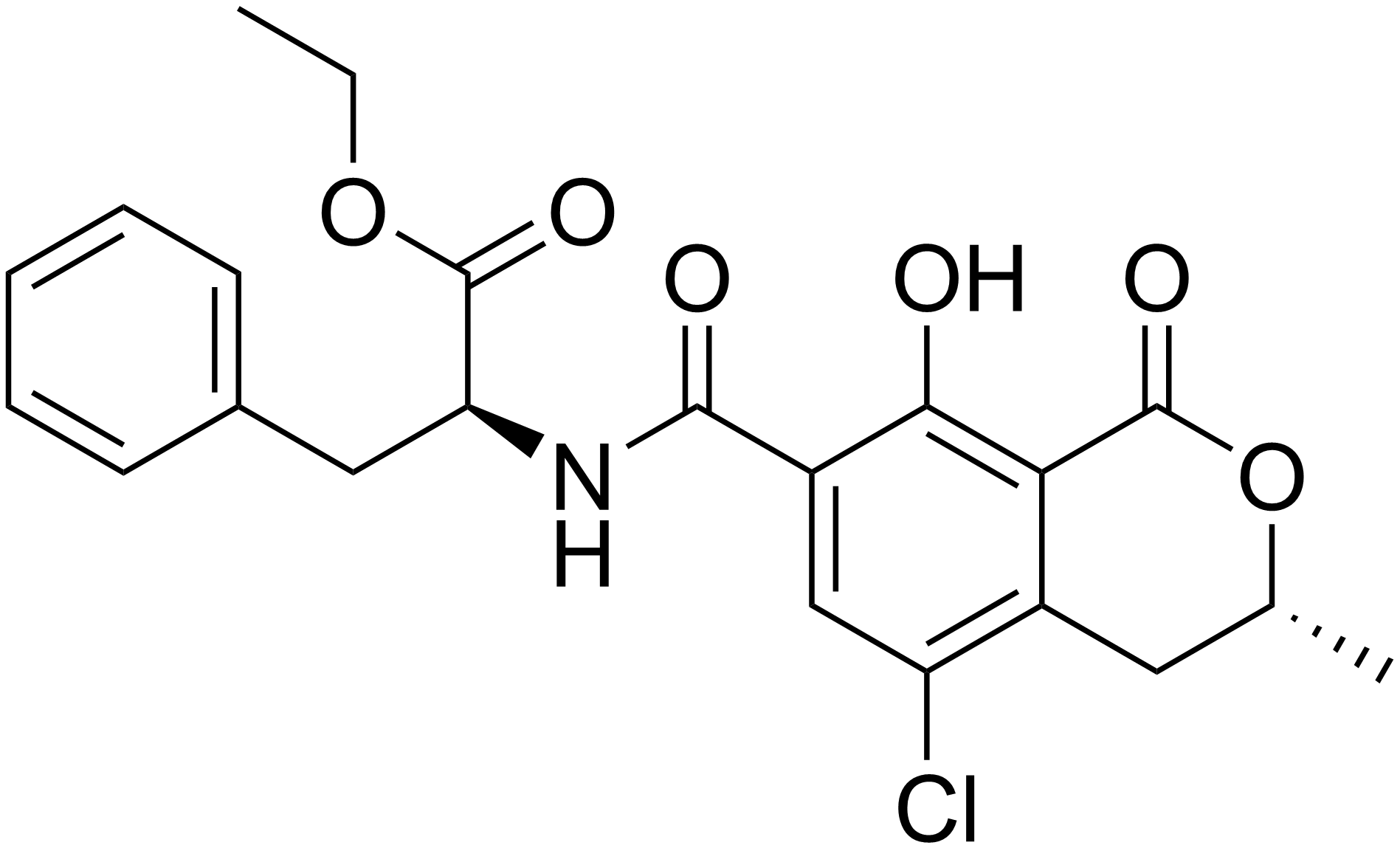
Okratoksin C
OTA’nın etil esteri olan Okratoksin C’ye (OTC) gıda ve hayvan yemlerinde doğal kontaminant olarak ender rastlanır. Ancak çok yüksek konsantrasyonda OTA içeren yemlerde OTC varlığına rastlanmaktadır. Galtier ve Alvinerie (1976) tarafından yapılan bir çalışmada inek ve koyunlara ait işkembe sıvılarının OTA’yı hidrolize ettiği ve OTC’ye dönüştürdüğü tespit edilmiş ve araştırmacılar bu durumun geviş getiren hayvanların ön midelerinde bulunan protozoa ve bakteriyel enzimler tarafından gerçekleştirildiğini ileri sürmüşlerdir. Bu nedenle hayvansal orijinli gıdalarda kalıntı olarak bulunan OTC’nin halk sağlığı problemlerine yol açabileceği sonucu ortaya çıkmaktadır (Fuchs vd 1984).
Okratoksin A çoğunlukla subtropikal ve ılıman iklimlerdeki tahıllarda, kahve çekirdekleri, kakao, kuru incir, yaş ve kuru üzüm, fındık, yer fıstığı ve karışık yemlerde sıkça saptanan en önemli mikotoksinlerden biri olarak kabul edilmektedir. Ayrıca bira, şarap ve üzüm suyu gibi yan ürünlerde de varlığı tespit edilmiştir.
Bitkisel ürünler içerisinde buğday, arpa, yulaf, çavdar, mısır ve pirinç gibi tahıllar OTA'yı yüksek konsantrasyonda içermelerinden dolayı, hem insanlar hem de hayvanlar açısından en önemli kontaminasyon kaynağıdır (Tunail 2001).
Gıda ve Tarım Organizasyonu (FAO) tarafından OTA üzerinden belirlenen Avrupa Birliği tarafından ise bebek mamaları için müsaade edilen düzey 1 µg/kg; tahıllar için ise 5 µg/kg olarak belirlenmiştir (Girgin vd 2001). İnsanlarda OTA için tolere edilebilir günlük alım düzeyi (Tolerable Daily IntakeTDI) Dünya Sağlık Örgütü tarafından 14 ng/kg olarak bildirilmiştir. Gıda Toksikolojisi ve Risk Değerlendirmesi Nordik Çalışma Grubu tarafından yapılan değerlendirmede kabul edilen TDI 5 ng/kg’dır. Kanada Uzmanlar Grubu ise TDI için 1.2-5.7 ng/kg değerini önermektedir (Barlow vd 2008).
Farklı gıda maddelerindeki izin verilen Okratoksin A limitleri
| Ürün | Limit (µg/kg) |
| Çocuk ve bebek mamaları | 0.5 - 5 |
| Yiyecekler | 2 - 50 |
| Hayvan yemi | 5 - 300 |
| Şarap | 0.2 - 1 |
| Bira | 0.2 |
| Yeşil kahve tohumu | 8 |
| Kavrulmuş kahve ve ürünleri | 4 |
OTA’nın Hayvanlarda Emilimi, Organ Dağılımı ve Metabolizması
OTA’nın gastrointestinal sisteme girişi gıdalar yolu ile olmaktadır. Geri emilimin hangi kısımda gerçekleştiği hakkında çeşitli görüşler bulunmakla birlikte, farelere ağız yolu ile verilen OTA’nın bağırsaklardan, esas olarak jejunumun başlangıç kısmında absorbe edildiği bildirilmiştir. OTA’nın emilim yerinin belirlenmesi amacıyla yapılan bir başka çalışmada ise, az bir miktarının mide ve özofagus epitel hücreleri tarafından gerçekleştirildiği, temel emilim yerinin ise duedonum ve jejunum olduğu ortaya konulmuştur (Lee vd 1984).
Genel olarak midede yüksek oranda besin bulunması, mide içeriğinin bağırsağa geçişini geciktirmekte ve bu gecikmenin, OTA’nın emilim hızını yavaşlattığı düşünülmektedir. Yapılan çalışmalar, standart laboratuvar deneylerinde kullanılan pellet yemlerin içeriğinin toplam lif oranının yüksek olmasının, bu liflerin OTA’nın hayvanlarda gastrointestinal sistemden emilimini azaltıcı aktif adsorbant etkisi gösterdiğini düşündürmüştür. Bu olayın, bazı bitki hücre duvarı bileşenlerinin mikotoksini yakalayarak, gastrointestinal sistemden toksinin emilimini engelleyip, dışkı yolu ile atılımını sağlaması ile gerçekleştiği sanılmaktadır. Sonuç olarak midede yer alan yüksek oranda besin içeriği ile OTA’nın daha uzun süreli teması, emilimi etkileyen bir etmen olarak gösterilebilmektedir (Vettorazzi vd. 2010).
Emilim sonrası portal ven yolu ile lenfatik sisteme taşınan OTA yüksek bağlanma kapasitesine sahiptir. Dolaşım sistemine ulaşınca serum albumin ve diğer makro moleküllere bağlanmakta ve yalnızca % 0,02’si bağlanmadan kalmaktadır. (Ringot vd 2006)
Ağız yolu ile verilen toksinin yarılanma ömrü, intravenöz enjeksiyona göre daha kısadır. Toksinin bir bölümünün eleminasyona uğradığı bölge karaciğer olup daha sonra safra ile atılmaktadır. Karaciğerden toksinin uzaklaştırılması, karaciğer hücre membranında bulunan organik anyon transport polipeptid taşıyıcı (OATP) adı verilen safra asidi taşıyıcısına bağlıdır. Toksin atılımının gerçekleştiği bir diğer önemli organ ise böbrektir. OTA’nın, plazma proteinlerine yüksek bağlanma potansiyeli nedeni ile glomerüler filtrasyon ile değil, tübüler sekresyon ile idrara geçtiği düşünülmektedir. Bu işlem, proksimal tübül hücresinin bazolateral hücre membranında bulunan ksenobiyotik taşıyıcısı para amino hippürik asit (PAH) sistemi ile gerçekleşmektedir. OTA’ya uzun süreli temas, hücrenin genel fonksiyonunu etkilememekle beraber, organik anyon transportunu azalttığı düşünülmektedir. OTA, tüm nefron segmentlerinden geri emilmekte olup; bu durum toksinin böbrek dokusunda toksisitesinin artmasına neden olmaktadır. Toksinin kandan taşıyıcı aracılığı ile ayrılması organizma için toksisite riskini azaltmakta fakat aynı zamanda böbrek ve karaciğer gibi atılımın gerçekleştiği organlarda toksisite artışına neden olmaktadır (Girgin vd 2001).
OTA vücuda alındıktan sonra bir kısmı değişmeden, bir kısmı da metabolitleri şeklinde idrar ve dışkı yolu ile atılmaktadır. OTA’nın vücuttan atılımını belirlemek için yapılan bir çalışmada, sıçanlara ağız yolu ile verilen OTA’nın idrarda % 6’sının OTA, % 1.5’nin (4R)-4-hidroksiokratoksin A ve % 25-27’sinin ise okratoksin α şeklinde atıldığı belirlenmiş, dışkıda ise % 12 oranında OTA’nın değişmeden, % 9 oranındaki OTA’nın ise okratoksin α şekline dönüştürülerek atıldığı tespit edilmiştir (Storen vd 1982).
OTA Toksisitesi
Çeşitli araştırmalar OTA‘nın kanserojenik, genotoksik, teratojenik, immünotoksik ve nefrotoksik olduğunu ortaya koymaktadır. OTA; DNA kırılmaları, protein sentezinin inhibisyonu ve glikoneogenezis, lipid peroksidasyonu, mitokondrideki oksidatif fosforilasyonun bozulmasına neden olmakta, ayrıca kanın pıhtılaşmasının engellenmesi ve apoptotik etkisinden dolayı büyük önem taşımaktadır. (Anonymous 1998).
OTA’nın toksisitesi hakkında çelişkili raporlar bulunmaktadır. Daha önce yayınlanmış olan bazı raporlar OTA’yı ana toksik ajan, metabolitlerini daha az toksik moleküller olarak gösterirken, bazı araştırmacılar da toksik etkilerin metabolitlerinden birine bağlı olabileceğini ileri sürmüşlerdir. OTA metabolitlerinin, toksisite üzerine etkisi tam olarak aydınlatılamamıştır (Ringot vd 2005).
OTA’nın Kanserojen Etkisi
İnsanlarda OTA’nın kanserojen etkisi ile ilgili yeterli kanıt olmamakla birlikte, kemirgenlerde kanserojenik etki gösterdiği birçok derlemede sunulmuştur (Leszkowicz vd 2006). Bendele vd (1985) tarafından deney hayvanları ile yapılan bir çalışmada; 24 ay süresince 40 ppm doz uygulanan gruptaki erkek farelerde renal neoplazmalar, karsinom ve adenomlar gözlenmiştir. 20 ay boyunca hayatta kalan hayvanların %28,57’sinde renal karsinom görülmüştür. 40 ppm doz uygulanan gruptaki tüm erkek farelerde nefropati (renal tubeler genişleme, tübüllerde rejeneratif hücre çoğalması) gelişmiştir. 40 ppm doz uygulanan dişilerde de benzer, fakat daha az şiddette renal değişikliklere rastlanmış, fakat karsinom ve adenomlara rastlanmamıştır. 1 ppm doz uygulanmış olan gruplarda böbrek lezyonu oluşmamıştır. OTA içeren yem ile beslenen erkek ve dişi sıçanlarda karaciğer hücre neoplazmalarında belirgin bir artış gözlenmiştir.
Bu çalışma OTA’nın erkek farelerde renal kanserojen, dişilerde ise karaciğer kanserojeni olduğunu ortaya koymuştur. Boorman ve arkadaşları (1989) yapmış oldukları kapsamlı bir çalışmada, her iki cinsiyeti içeren sıçanlara 16 gün, 13 hafta, 9 ay, 15 ay ve 2 yıl boyunca, haftada 5 gün değişen oranlarda ağızdan sonda yolu ile OTA vermişlerdir. İki yıllık çalışma süresince 9, 15 ve 24. aylarda idrar tahlilleri, kemik iliği, hematolojik ve serum kimyasal analizleri yapılmış, bakteri ve memeli hücreleri ile de genetik toksikoloji testleri uygulanmıştır. İki yıllık ağız yolu ile sonda uygulaması, erkek sıçanlarda oldukça artan düzeylerde beklenmedik tübüler hücre adenomları ve böbrek hücre karsinomları gibi OTA’nın kanserojen aktiviteleri için bariz kanıtlar sunmuştur. Dişi sıçanlarda da, böbreklerde yüksek oranlarda tübüler hücre adenomaları ve karsinomalar ile meme bezlerindeki fibro adenomaların çokluğu, OTA’nın kanserojen etkisi için birer kanıt oluşturmuştur. OTA uygulamasının ayrıca tübüler hücre hiperplazisi, tübüler hücre poliferasyonu, sitoplazmik değişimler, karyomegali ve böbrek hücrelerinde dejenerasyon gibi farklılaşmalara neden olduğu bildirilmiştir.
Stoev (2010) OTA bağımlı kanserlerlerin azaltılmasında L-fenilalenin’in (LPhe) muhtemel koruyucu etkisini tespit etmek için, civcivler üzerinde yapmış olduğu bir çalışmada, her grupta 5 erkek 5 dişi olacak şekilde hayvanları 3 gruba ayırmıştır. Birinci grup kontrol, diğerleri ise sırası ile 5 ppm OTA alan ve 5 ppm OTA ile birlikte 25 ppm L-Phe içeren yemlerle beslenen gruplardır. Yapılan incelemelerde böbreklerde adenokarsinomalar, üreterlerin belirli bölgelerinde ve karaciğerde kanserler tespit edilmiştir. İlginç bir şekilde L-Phe yokluğunda OTA uygulanan erkeklerin 4/5’inde tümör oluşumu gerçekleşirken, dişilerde bu oran 1/5’dir. Aksine L-Phe varlığında, OTA uygulanan erkeklerde tümör oluşumu gözlenmezken, dişilerin 3/5’inde tümörler gelişmektedir. Bu çalışma göstermiştir ki, L-Phe dozu erkek civcivlerde kanserin ortaya çıkışında koruyucu bir etki ortaya koyarken, dişilerde tümör oluşumunu arttırmış ve böylece OTA bağımlı kanserlerde cinsiyet farkının aydınlatılmasına yardımcı olacak bilgiler sunmuştur.
OTA’nın Teratogenez ve Mutagenez Etkisi
OTA’nın sıçan, fare, hamster ve tavuklarda teratojen olduğu bilinmektedir. Domuzlarda ise teratojen etkisinin diğer türler kadar kuvvetli olmadığı sanılmaktadır. OTA’nın teratojenik etkisi türler arasında farklılıklar gösterir. Bu farklılığın OTA’nın türler arasındaki duyarlılık farkıyla ve kan-plasenta bariyerindeki farklılıktan dolayı meydana geldiği düşünülmektedir. OTA uygulanan sıçanların yavrularında özellikle merkezi sinir sistemi, göz ve iskelet yapısında anormalliklere rastlanmıştır (Girgin vd 2001). OTA’nın deney hayvanlarının immun sistemi, sinir sistemi ve iskelet yapısını etkilediği için teratojen olarak sınıflandırılmasında deneysel dayanaklar bulunmaktadır. (Barlow vd 2008).
Mikroorganizma ve memeli hücreleriyle yapılan bir dizi mutasyon testlerinde, OTA’nın non-mutajenik çıkmasına rağmen, modifiye edilmiş Ames Testi, insan periferal lenfositleri ile yapılan in vitro kardeş kromatit değişimi testi ve Escherichia coli ile yapılan SOS DNA onarım testinde mutasyonu indüklediği tespit edilmiştir. Bunun yanı sıra OTA maruziyeti sırasında kromozom hasarı gözlenebilmekte; insanların karaciğer, böbrek, geviş getirenlerin işkembelerinde ve maymunların böbrek hücrelerinde DNA katım ürünlerine rastlanmaktadır (Neal 1995).
İmmunosupresyon Etkisi
Okratoksin A’nın ng/ml düzeyindeki çok düşük konsantrasyonlarının bağışıklık sistemini etkileyebildiği ve immün sistemi baskılayan bir ajan olduğu yapılan çalışmalarla tespit edilmiştir (Petzinger ve Weidenbach 2002).
Bu konuda yapılan pek çok çalışmada OTA’nın farelerde ve piliçlerde kandaki immünglobulin seviyesini etkilediği tespit edilmiştir. Chang ve Hamilton (1980) tarafından yapılan bir çalışmada; piliçlerde 20 gün boyunca yemlerine ilave edilen 0-8 mg/kg OTA’nın lenfoid hücrelerin sayısında azalmaya neden olduğu, serum ve lenfoid dokularda IgG, IgA ve IgM’yi baskıladığı tespit edilmiştir. Haubeck vd (1981) tarafından OTA’nın immünosupresif etkisi üzerine fenilalaninin nasıl bir rol oynadığını belirlemek amacıyla yapılan bir çalışmada; fenilalanin konsantrasyonunun OTA konsantrasyonundan iki kat daha fazla olduğu durumlarda immnosupresif etki gözlemlenmediğini yada etkinliğinin azaldığını rapor etmişlerdir.
Mitokondriyal Hasarlar
Yapılan çalışmalar, OTA’nın mitokondrial fonksiyonu etkilediğini ve mitokondrial hasara neden olduğunu göstermektedir. OTA, piliç ve bıldırcınların karaciğerinde ve böbreklerin proksimal tübüllerinde yer alan mitokondrial yapıda patolojik değişimlere neden olarak, serbest radikallerin üretimine ve oksidadif strese sebebiyet vermektedir. OTA’nın mitokondrial ATP üretimini engellediği ve lipid peroksidasyonunu teşvik ettiği rapor edilmiştir (Bennett ve Klich 2003).
OTA’nın izole edilmiş sıçan karaciğer mitokondrisinde, solunumu inhibe ettiği ve mitokondrial morfolojiyi değiştirdiği gösterilmiştir. ATP azalması ile ilişkili olan bu olay, mitokondri iç membranında yer alan taşıyıcı proteinlerin kompetatif inhibasyonu neticesinde, mitokondri içerisine fosfat geçişinin inhibe edilmesinin ve elektron taşıma sistemi üzerine doğrudan etkisinin bir sonucu olarak kabul edilmiştir (Meisner ve Chan 1974).
Renal korteksten izole edilen mitokondrilerde mikromolar seviyedeki OTA ‘nın ATP sentezini engellediği bildirilmiş, yapılan bir başka hücre kültürü çalışmasında ise nanomolar konsantrasyondaki OTA’nın mitokondrial aktiviteyi baskıladığı belirtilmiştir. Bu bilgiler ışığında mitokondrial fonksiyon bozukluğunun OTA’nın kanserojen ve toksik etkisi üzerindende bir rolü olabileceği muhtemelsede, bu ilişkiyi açıklamak için daha fazla araştırmaya gerek duyulmaktadır (Schilter vd 2005).
2.4.5. DNA, protein ve RNA üzerindeki etkileri
Yapılan çalışmalar OTA’ya maruz bırakılan sıçanlarda dalak, böbrek ve karaciğer hücrelerinde DNA zincirinde kopmaların meydana geldiğini belirtmektedir. OTA’nın esas etkisinin fenilalenin metabolizması üzerine olduğu ve fenilalenin tRNA kompleksini engellediği belirtilmiştir. OTA, fenilalanin tRNA (Phe-tRNA) sentetaz tarafından katalizlenen Phe-tRNA aminoaçilasyon reaksiyonunu fenilalenin ile rekabet ederek inhibe ettiği öne sürülmektedir. Protein sentezi inhibasyonuna ilaveten OTA tarafından DNA ve RNA sentezi de inhibe edilmektedir (Bennett ve Klich 2003).
Kane vd (1986) yaptıkları çalışmada, sıçanlarda 12 hafta boyunca toplamda 4 mg/kg alım seviyesine ulaşılacak şekilde oral yolla OTA verilmesi sonucunda böbrek ve karaciğer dokularında DNA’da tek iplik kopukluklarının meydana geldiğini bildirmişlerdir.
Nefrotoksisitesi
Yapılan fizyolojik çalışmalar OTA’nın nefron boyunca farklı yerlerde toksik etki gösterdiğini ortaya çıkarmıştır. OTA, bütün nefron segmentlerinden geri emilir. Bu süreç toksinin böbrek dokusunda toksisitesinin artmasına neden olur. Akut olarak OTA’ya maruz kalma, post proksimal nefron fonksiyonunda bozulmalara yol açmakta, özellikle toplama kanalında elektrolit ve titre edilebilen asit atılımında değişikliklere sebep olmaktadır. Hücrelerdeki pH dengesinin bozulması OTA’nın böbrek hücrelerine alınımı ile ortaya çıkmaktadır. Kronik olarak OTA’ya maruz kalma, ürenin konsantrasyonunda azalmaya neden olmaktadır. OTA varlığında aminoasit gibi küçük moleküllerin emilme kapasiteleri daha az derecede etkilenmekte iken, albüminin endositotoik alınımı oldukça azalmaktadır. OTA, doz ve zamana bağlı olarak renal fonksiyon üzerinde kompleks etkiler ortaya çıkarmaktadır. Yapılan çalışmalar sonucunda OTA’nın, sıçan proksimal tübül hücre kültürüne nanomolar konsantrasyonlarda uygulandığında mutajenik potansiyele sahip olduğu, ancak mikromolar konsantrasyonlarda hücre gelişimini inhibe ettiği tespit edilmiştir (Gekle ve Silbernaql 1996).
Yapılan çalışmalarda, uygun koşullarda depolanmayan yemlerdeki OTA kontaminasyon derecesi ile domuzlarda nefropati görülme sıklığı arasında pozitif bir ilişki olduğu ortaya konmuştur. İtalya’da Alp bölgesinde yapılan bir çalışmada, yüksek oranda OTA içeren yemlerle beslenen domuzların böbrek ve mesanelerinde birçok makroskobik ve mikroskobik lezyonların oluştuğu gösterilmiştir (Leszkowicz vd 2009).
Danimarka, Polonya ve Macaristan’daki birçok araştırma OTA’nın domuzlarda görülen nefropatilerde önemli bir rol oynadığını ortaya koymuştur. 0.2, 1 ve 4 ppm OTA içeren yem ile beslenen domuzlarla yapılan bir çalışmada 1ve 4 ppm doz uygulanan hayvanların 3-4 aylık süre içerisinde böbreklerinde renk kaybı, nekrozlar ve proksimal tübülün epitel hücrelerinde lezyonlar gözlenmiştir (Leszkowicz vd 2006).
Rasonyi vd (1998) yaptıkları bir çalışmada yedi gün süresince oral sonda yolu ile günlük 1mg/kg OTA uyguladıkları dişi ve erkek sıçanlarda, başlıca proksimal tübülün P3 segmentinde karyomegali, apoptatik nekroz ve tüm tübül boyunca hücre rejenerasyonunda artış gibi bir takım fark edilebilir değişiklikler gözlemlemişlerdir.
Tüm bu bulgular ışığında, yüksek yada düşük dozdaki OTA’nın akut yada kronik etkisinin, bariz patolojik değişikliklere sebep olduğu, bununda akut nefropatilere ve böbrek tümörlerine yol açabileceği bildirilmiştir.
OTA, bütün memelilerde akut ve kronik lezyonlara sebep olan önemli bir nefrotoksindir. İn vivo ve in vitro sistemlerde mutajenik etkisi kanıtlanmış, ancak etki mekanizması henüz açıklanamamıştır.
IARC tarafından insanda muhtemel kanserojen madde (Grup 2B) olarak sınıflandırılmıştır. Diğer taraftan OTA, özellikle Balkan Ülkelerinde Tuna nehri kıyısı kırsal bölge insanlarında görülen Balkan Endemik Nefropati (BEN) hastalığından, Mısır’da ve Tunus’ta görülen ve etyolojisi bilinmeyen nefropatilerden ve böbrek tümörlerinden sorumlu tutulmaktadır. 1970’li yıllarda çoğunlukla domuzlarda ve kümes hayvanlarında görülen toksik etkilerle, bu endemik hastalığın klinik ve patolojik özellikleri arasındaki çarpıcı benzerlikleri görülmesi üzerine OTA ile BEN arasındaki ilişkiyi çözmeye yönelik çalışmalar yoğunlaştırılmıştır (Fuchs ve Peraica 2005).
Bulgaristan ve Hırvatistan daki endemik bölgelerde, gıdalarda OTA kontaminasyonu ile ilgili birçok çalışma yapılmıştır. Buğday, mısır, arpa, patates, buğday ekmeği gibi pek çok ürün ve hayvan yemleri analiz edilmiştir. Hem endemik hemde kontrol bölgelerinden toplanan tüm gıda örneklerinde ve yemlerde değişen oranlarda OTA bulunmuştur. Yapılan diğer bir çalışmada ise kontrol bölgelerine kıyasla endemik bölgelerde daha yüksek oranda OTA’lı örneklere rastlanmıştır. Hırvatistan’da endemik bölgeden toplanan buğday ve mısır örneklerinin, dört ayrı kontrol bölgesinden toplanan örneklerle karşılaştırıldığı bir çalışmada, ortalama OTA konsantrasyonu ve OTA pozitif numunelerin bulunma frekansı daha yüksek oranda bulunmuştur (Fuchs ve Peraica, 2005).
Bulgaristan’da 1984, 1986, 1989 ve 1990 yıllarında endemik ve endemik olmayan bölgelerden 576 kan örneği toplanmış, araştırılan tüm gruplarda OTA’ya rastlanmış, fakat bölgeler karşılaştırıldığında, BEN ve idrar yolu tümörleri bulunan hastaların kanlarında OTA miktarı daha yüksek olarak bulunmuştur (Petkova vd 1991).
Yapılan çalışmaların neredeyse tümünde, endemik bölgelerde kontrol bölgelere oranla bölge sakinlerinin kanlarında ve gıdalarında daha sık oranda ve daha yüksek konsantrasyonda OTA tesbit edilmiştir. Her ne kadar yapılan tüm çalışmalar, endemik bölge sakinlerinin daha yüksek oranda OTA’ya maruz kaldığını gösterse de, tüm laboratuvar hayvanlarında OTA’nın nefrotoksik oluşu, insanlarda da aynı etkiyi yapabileceği beklentisini doğursa da, BEN görülmeyen ülkelerdeki insanların kanlarında da OTA tespit edildiği için, OTA ile BEN ve idrar yolu tümörleri arasında bir bağ kurmak hala tam olarak mümkün olamamaktadır (Fuchs ve Peraica 2005).
Hepatotoksisite
OTA’nın karaciğerde hücre ölümüne (apopitoz) neden olduğu Atroshi vd (2000) yapmış oldukları çalışmada ortaya konmuştur. Bir ve iki haftalık periyotlar boyunca haftada iki kez OTA uygulamasını takiben, fare karaciğerlerinde hücre ölümleri gözlenmiştir. Işık mikroskobu ile yapılan incelemelerde karaciğer hücre stoplazmasında apoptotik yapılar içeren eozinofilik globüllerin sayısının iki haftalık periyotta kontrol değerlerine oranla sekiz kat arttığı görülmüştür. Ayrıca yapılan biyokimyasal ve histolojik analizler sonucunda birinci hafta sonunda hücresel nekrozlarla ilgili herhangi bir belirti tespit edilmemişken, ikinci haftada sentrilobular nekrozlar gözlemlenmiştir.
Storen vd (1982) tarafından sıçan yemlerine OTA ilave edilmesinden sonra yapılan glukoz tolerans testinde, kan glukoz değerlerinin normal değerlere ulaşamadığı, karaciğerdeki total karbonhidrat ve glukojen seviyeleri ile glikolitik enzimlerin aktivitesinde düşme gözlenirken, glukoneojenik enzim seviyesinde ise yükselme kaydedildiği belirtilmiştir.